Auf dieser Seite finden sie eine Sammlung an allgemeinen Fragen zur IMPACT-Studie und Fragen zum Studienablauf, die uns schon häufiger gestellt worden sind. Wenn Sie eine Frage haben, könnte es gut sein, dass Sie auf dieser Seite eine Antwort finden. Falls dies nicht der Fall sein sollte, kontaktieren Sie bitte unser Studienteam. Für weitere Informationen stehen wir Ihnen immer zur Verfügung.
Allgemeine Fragen und Informationen zur IMPACT-Studie
Wie funktioniert IMPACT?
Jedes Krankenhaus sammelt Daten über jeden geeigneten Patienten, d.h. jeden prämedizierten Patienten, der die Ein- und Ausschlusskriterien erfüllt. Dabei ist es für die Studienteilnahme egal, ob der Patient eine medikamentöse Prämedikation erhält oder nicht. Die Datenerhebung erfolgt am Tag der Prämedikation, am OP-Tag, im AWR, sowie am 1. postoperativen Tag. Eine Follow Up Visite erfolgt am 30. postoperativen Tag, entweder persönlich auf Station oder per Telefon.
Wie lange läuft die Studie?
Die Studie wird bis zum Einschluss von 4000 Patienten fortgeführt.
Wer kann teilnehmen?
Wir würden uns über so viele Krankenhäuser wie möglich aus ganz Deutschland freuen.
Jeder eingeschlossene und vollständig dokumentierte Patient wird in die Datenanalyse einbezogen.
Gibt es eine Mindestpatientenzahl, die in die Studie aufgenommen werden sollte?
Nein. Jeder eingeschlossene Patient ist für die IMPACT-Studie wertvoll. Natürlich würden wir uns freuen, wenn die Zentren nicht nur einen Patienten rekrutieren würden, da insgesamt ein Rekrutierungsziel von 4000 Patienten angestrebt ist.
Welche Daten sollen erhoben werden?
Alle Daten, die für die Studie erhoben werden müssen, finden sie in der Case Report Form (CRF). Dieses CRF sollte für jeden Patienten ausgedruckt und ausgefüllt werden.
Was ist wenn wir in den meisten Fällen keine Prämedikation geben?
Das ist kein Problem, da die Studie sowohl Patienten, die eine medikamentöse Prämedikation bekommen haben betrachtet, als auch Patienten ohne. Die Entscheidung ob ein Patient eine Prämedikation erhält soll von der Studie unbeeinflusst bleiben und dem klinischen Standard entsprechen.
Können wir auch teilnehmen, wenn die Rekrutierungsphase bereits begonnen hat?
Ja, natürlich! Teilnehmen können alle Zentren, die ihre Genehmigung durch die zuständige Ethikkommission bis zum Ende der Studie erhalten haben.
Wird meine Arbeit an der Studie anerkannt?
Jedes teilnehmende Zentrum mit mindestens einem Patienten kann einen sog. „Collaborator“ benennen, der in der IMPACT-Study group in den Publikationen erwähnt wird. Alle Collaborators werden über eine PubMed Suche zu finden sein. Die Anzahl der genannten Mitarbeiter hängt von der Anzahl der eingeschlossenen Patienten ab. Das bedeutet:
- 25 eingeschlossene und dokumentierte Patienten => 1 collaborators
- 50 eingeschlossene und dokumentierte Patienten => 2 collaborators
- 75 eingeschlossene und dokumentierte Patienten => 3 collaborators
- 100 eingeschlossene und dokumentierte Patienten => 4 collaborators
- 125 eingeschlossene und dokumentierte Patienten => 5 collaborators
- 150 eingeschlossene und dokumentierte Patienten => 6 collaborators
- etc.
Top-Rekruter mit ≥75 eingeschlossenen und vollständig dokumentierten Patienten können zusätzlich zum vorherigen Absatz einen oder mehrere Co-Autoren benennen, gemäß der hier geltenden Veröffentlichungsrichtlinie.
Das bedeutet:
- 75 eingeschlossene und dokumentierte Patienten => 1 Co-Autor (+ die oben genannten collaborators)
- 150 eingeschlossene und dokumentierte Patienten => 2 Co-Autoren (+ die oben genannten Collaborators)
- etc.
Zusätzlich stellen wir jeder Person, die in der IMPACT-Studie gemäß der Deligierungsliste mitgearbeitet hat, ein Teilnahmezertifikat aus.
Wozu dient das IMPACT-Glossary?
In dem angefügten Glossary sind alle Visiten der IMPACT-Studie, sowie die durchzuführenden Tests erläutert und wichtige Fakten und Definitionen erklärt. Es handelt sich hierbei um eine praktische Hilfe und kleines Nachschlagewerkt zur IMPACT-Studie. Natürlich stehen wir Ihnen bei akuten Problemen und Fragen weiterhin zur Verfügung.
Wozu dient der ISF – Investigator Site File?
Nach Erhalt des positiven Ethikvotums bekommen alle Zentren einen Studienordner (Investigator Site File = ISF) zugesendet. Hier sollen studienbezogene Dokumente abgelegt und die spezifischen Logs
(Delegation-Log, Screening-Log etc.) geführt werden.
- Das Screening-Log kann selbstverständlich auch digital geführt werden, jedoch muss ein Ausdruck regelmäßig im ISF abgeheftet werden. Wir bitten den PI die Ausdrucke gegenzuzeichnen.
- Eine genaue Erläuterung zur Handhabung und Führung des
Studienordners erfolgt während der Telefoninitiierung.
Wichtig: der ISF ist zentrumsspezifisch und verbleibt mit den Akten der Studienteilnehmern bei Ihnen am Zentrum.
Fragen zu Screening und Einschluss
Welche Patienten sollen eingeschlossen werden?
Alle Patienten ≥ 18 Jahre mit einer geplanten elektiven Operation in Vollnarkose (mit oder ohne Regionalanästhesie). Dabei spielt es keine Rolle, ob der Patient eine medikamentöse Prämedikation bekommt oder nicht. Dies liegt alleine im Ermessen des prämedizierenden Kollegen/der prämedizierenden Kollegin und bleibt von der Studie unbeeinflusst.
Sollen wir jeden Patienten einbeziehen, der den Einschlusskriterien entspricht und keine Ausschlusskriterien hat?
Ja, alle Patienten, die den Einschlusskriterien entsprechen und keine Ausschlusskriterien haben, sollen gescreent und in die Studie eingeschlossen werden. Da es bei der Konstellation von Ein- und Ausschlusskriterien sein kann, dass sehr viele Patienten für die Studie geeignet sind, können wir auf Ihren Wunsch die in Frage kommende Patientenzahl reduzieren. Dies geschieht durch die zufällige Zuteilung von 1-3 Geburtsmonaten pro Zentrum. D.h., Sie schließen dann nur die Patienten mit dem entsprechenden zugeteilten Geburtsmonate in die Studie ein.
Wieso wird das Screening der Patienten durch Geburtsmonate eingeschränkt?
Im Rahmen der Initiierung weisen wir Ihnen bestimmte Geburtsmonate zu, um die Zahl an geeigneten Patienten zu reduzieren. Das hat den Hintergrund, dass anhand der Ein- und Ausschlusskriterien sehr viele Patienten in Frage kommen werden. Damit dann keine Bias bei der Auswahl der Patienten entsteht, wenn man die Patienten nicht alle befragen oder einschließen kann, reduzieren wir so die Zahl der Screening-Failures.
Die Anzahl der Geburtsmonate werden wir bei der telefonischen Initiierung mit Ihnen Absprechen. Dies ist vor allem davon abhängig, an wie vielen Tagen pro Woche Sie Patienten rekrutieren wollen.
Sollte sich nach Zuteilung von zwei oder mehr Geburtsmonaten zeigen, dass die Auswahl zu groß oder zu klein gewesen ist, kann die Anzahl der zugeteilten Geburtsmonate durch uns auch noch im Verlauf angepasst werden.
Wie soll man mit einem Drop out umgehen?
Falls Sie einen Patienten in die Studie einschließen, den Informed Consent einholen und das Baseline Assessment durchführen, der geplante Eingriff jedoch gar nicht stattfindet, so werten wir diesen Patienten als Drop-out. Bitte gehen Sie dazu wie folgt vor:
Legen Sie den Patienten wie gewohnt im OC an, füllen die Baseline Visite aus und anschließend direkt die End of Trial (EOT) Visite. Hierbei wählen Sie das Feld „Other“ aus und geben kurz den Grund an, z.B.: „OP wurde abgesagt“.
Zusätzlich bitten wir Sie, uns solche Patienten kurz per Mail zu melden, damit wir die nicht zutreffenden Visiten sperren und so unnötige Rückfragen am Ende der Studie vermeiden können.
Muss ich jeden Patienten in das Screening Log eintragen?
Nach Möglichkeit sollen alle Patienten eines Tages, die in Frage kommen, gescreent werden. Doch manchmal hat man nicht den ganzen Tag Kapazität alle Patienten zu screenen.
Da es sich bei IMPACT um eine pragmatische Studie handelt, soll man natürlich nur die Patienten in die Screeningliste eintragen, die man auch wirklich gescreent hat. D.h. wenn Sie heute nur 4h screenen, dann sollten sie auch nur die möglichen Patienten aus diesen 4h in die Screeningliste eintragen.
Kann man auch Patienten einschließen, die im Rahmen eines Folgeeingriffes operiert werden?
Auch Patienten, die im Rahmen des stationären Aufenthaltes eine Folgeoperation (geplant oder ungeplant) erhalten, können für diese in die Studie eingeschlossen werden.
Natürlich können Folgeeingriffe Einfluss auf das generelle Outcome des Patienten haben, da aber der primäre Endpunkt nicht davon betroffen ist, können diese Patienten eingeschlossen und auch bis zum Ende nachverfolgt werden.
Kann man einen Patienten auch am Tag der OP selbst noch einschließen?
Da es sich bei der IMPACT-Studie um eine BOÄ-Studie handelt, darf ein Patient auch noch am OP Tag selbst eingeschlossen werden.
Fragen zu OpenClinica
Wie geht man mit nicht erhobenen Werten in OpenClinica um? Was soll man eintragen?
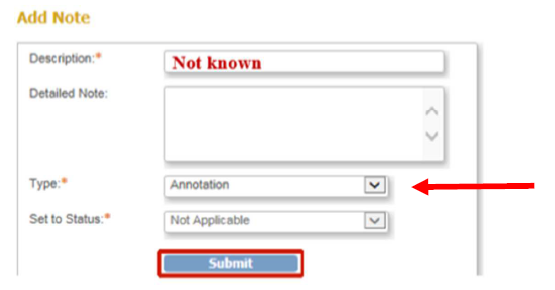
Wenn ein Wert nicht erhoben werden konnte oder beim Eingeben ins eCRF auffällt, dass dieser außerhalb des normalen Wertebereichs liegt, kann man dies durch Setzen eines Fähnchens begründen und somit abspeichern. Dazu klicken Sie jeweils auf das kleine Fähnchen rechts neben dem Eingabefeld und geben in dem neu geöffneten Fenster unter „Description“ eine kurze Erklärung für das Fehlen oder Abweichen der Daten ein (z.B. „Wert nicht erhoben“, „keine Daten“, etc.).
Wichtig ist hierbei, dass man den Type „Annotation“ auswählt, wodurch sich das Fähnchen weiß färbt.
Kann man in OpenClinica nachdem ein Event auf „CRF completed“ gesetzt wurde noch Daten korrigieren?
Eine Korrektur bzw. Ergänzung der Daten ist auch noch möglich, nachdem ein Event als „completed“ markiert wurde. Hierzu öffnen Sie das Event im Bearbeitungsmodus, korrigieren die Eingabe und setzen ein Fähnchen mit dem Type „Reason for Change“ und einer kurzen Erklärung.
Fragen zu Visite 0: Preoperative Screening and Baseline Visit
Wie funktioniert die Punktevergabe bei der Uhr im MiniCog?
Nur für die komplett korrekt gezeichnete Uhr mit richtiger Uhrzeit gibt es 2 Punkte. Andernfalls sind 0 Punkte zu vergeben. Es gibt immer wieder Patienten, welche die Uhr größtenteils richtig zeichnen, aber eine Zahl vergessen oder die Zeiger falsch eintragen. Auch in solchen Fällen werden nur 0 Punkte vergeben.
Auf welchen Zeitpunkt bezieht sich die subjektive Eigeneinschätzung des Patienten in der Visite V0?
In der Visite V0 wird der Patient/die Patientin gebeten, auf einer Skala von 0-100 die eigene Gesundheit einzuschätzen (EQ-VAS Score: „Your health today“). Es geht explizit um die Einschätzung am Tag des Gesprächs. Auch der EQ-5D-5L bezieht sich auf den Status des Patienten am Tag des Baseline-Gesprächs.
Wie im Glossary beschrieben, beziehen sich die Fragen nach dem funktionellen Status („independant“, „partially dependant“, „totally dependant“), nach Schmerzen (NRS – „pain“), Schlafqualität („sleep quality“) und Wohlbefinden („well-being“) auf den vorangegangen Monat.
Wieso wird in der V0 Visite die medizinische Vorgeschichte des Patienten abgefragt und wie soll man mit Unsicherheiten umgehen?
In der Visite V0 werden Fragen zur medizinischen Vorgeschichte beantwortet, die uns helfen, den Charlson-Komorbiditätsindex zu bestimmen und später in der Auswertung zu berücksichtigen. Falls Sie unsicher sind, wie bestimmte Vorerkrankungen definiert sind, finden Sie die entsprechenden Erläuterungen im Glossary auf den Seiten 6 – 8. Falls Sie weiterführende Fragen haben, melden Sie sich jederzeit gerne!
Fragen zu Visite 1: Surgery day, pre- and intraoperative
Wie geht man mit einem Patienten um, der nach OP ungeplant intubiert auf Intensivstation übergeben wurde?
Falls ein Patient ungeplant intubiert auf Intensivstation übergeben wurde, haben wir keine Angabe für die time to extubation. In diesem Fall sollte ein Fähnchen mit „keine Angabe“ gesetzt werden. Für die Angabe der „end of anaesthesia“ sollte hier die Zeit eingetragen werden, zu der der Patient den OP-Saal verlassen hat.
Wie geht man mit einem Patienten um, der ungeplant nur eine Analgosedierung bekommen hat?
Patienten, die für einen Eingriff in Vollnarkose geplant waren, im OP dann aber doch eine Analgosedierung erhalten haben, sollen im Sinne der „Intention to treat“ – Analyse weiterverfolgt werden und werden von uns separat analysiert. Das heißt, dass alle Nachuntersuchungen erfolgen sollen. Bei Visite 1 wird unter „Kind of anaesthesia“ nichts angekreuzt und ein Fähnchen mit der entsprechenden Erklärung gesetzt: „Pat. hat unerwartet eine Sedierung erhalten“.
Zudem bitten wir Sie, uns die OpenClinica-Nummer des entsprechenden Patienten per E-Mail zu schicken, damit wir einen internen Überblick behalten können.
Wie geht man mit einem Patienten um, dessen OP ungeplant ≤ 30min gedauert hat?
Patienten, deren OP ungeplanter Weise ≤30min gedauert hat, sollen im Sinne der „Intention to treat“ – Analyse weiterverfolgt werden und werden von uns separat analysiert. Das heißt, dass die Visite 1 normal mit allen Angaben dokumentiert wird und alle Nachuntersuchungen erfolgen sollen.
Wir bitten Sie, uns die OpenClinica-Nummer des entsprechenden Patienten per E-Mail zu schicken mit einer kurzen Angabe zur Abweichung, damit wir einen internen Überblick behalten können.
Wie geht man mit einem Patienten um, der ungeplant nur ambulant operiert worden ist?
Patienten, die ungeplanter Weise nur ambulant versorgt wurden, sollen im Sinne der „Intention to treat“ – Analyse weiterverfolgt werden und werden von uns separat analysiert. Das heißt, dass die Visite 1 normal mit allen Angaben dokumentiert wird und alle Nachuntersuchungen erfolgen sollen. Visite 3 soll wenn möglich auch telefonisch durchgeführt werden, auf den MiniCog kann man in diesem Fall jedoch verzichten und dies in OpenClinica mit einem Fähnchen markieren.
Zudem bitten wir Sie, uns die OpenClinica-Nummer des entsprechenden Patienten per E-Mail zu schicken mit einer kurzen Angabe zur Abweichung, damit wir einen internen Überblick behalten können.
Wie geht man mit einem Patienten um, der ungeplant nur eine Regionalanästhesie bekommen hat?
Patienten, die ungeplanter Weise nur eine Regionalanästhesie bekommen haben, sollen im Sinne der „Intention to treat“ – Analyse weiterverfolgt werden und werden von uns separat analysiert. Das heißt, dass alle Nachuntersuchungen erfolgen sollen. In Visite 1 kann bei allen Fragen zur Vollnarkose nichts angekreuzt und ein Fähnchen mit der entsprechenden Erklärung gesetzt werden: „Patient hat unerwartet nur Regionalanästhesie erhalten“.
Wir bitten Sie, uns die OpenClinica-Nummer des entsprechenden Patienten per E-Mail zu schicken mit einer kurzen Angabe zur Abweichung, damit wir einen internen Überblick behalten können.
Was tut man mit einem Patienten, der in den Saal gerufen und dessen APAIS bereits erhoben wurde, der aber dann nicht operiert wurde?
In diesem Fall sollte der APAIS-Score erneut am Tag der eigentlichen OP erhoben werden. Den bereits erhobenen APAIS-Score kann man verwerfen und nicht dokumentieren. Man zählt es allein als verschobene OP. Am besten druckt man den Zettel für die Anästhesisten erneut aus.
Fragen zu Visite 2: Surgery day, postoperative (PACU/ICU)
Wann soll die Visite 2 stattfinden und welche Uhrzeit wird hier abgefragt?
Die Visite 2 „Surgery day, post-operative“ soll im Aufwachraum bzw. auf der Überwachungsstation 0.5 – 1.5h nach OP stattfinden soll. Dieses Zeitfenster wurde ausgewählt, da die ersten Werte nach Ankunft durch Lagerungsmaßnahmen und Betten des Patienten noch verfälscht sein können.
Für diese Visite soll der Zeitpunkt der Ankunft des Patienten im Aufwachraum/Überwachungsstation angegeben werden, die Fragen bzgl. der Vitalparameter, Schmerzen und Übelkeit beziehen sich aber auf den Zeitpunkt der Visite (0.5-1.5h nach der OP).
Was soll ich machen, wenn die Visite 2 nicht im angegebenen Zeitfenster erfolgen kann?
Im Sinne der „intention to treat“ – Analyse, bitten wir Sie, die Visite 2 ggf. auch zu einem späteren Zeitpunkt durchzuführen, wenn dies innerhalb des Zeitfensters nicht möglich war. Diesbezüglich kann ein Kommentar in dem Fähnchen der ersten Frage von Visite 2 „Arrival at the PACU/ICU“ für uns hinterlassen werden.
Wie ist die Visite 2 bei ungeplanten Intensivpatienten auszufüllen?
Wird ein Patient postoperativ ungeplanter Weise beatmet auf die Intensivstation übernommen, können Fragen nach der Ankunftszeit, den Vitalwerten, PONV-Prophylaxe und Piritramidgabe erfasst werden.
Alle anderen Fragen, für die der Patient bei Bewusstsein sein muss, können offen gelassen werden. Hier soll per Fähnchen dokumentiert werden, dass sich der Patient beatmet auf Intensivstation befand. In der „End-of-Trial-Form“ kann, falls der restliche Studienablauf korrekt verlaufen ist, „per protocol“ angekreuzt werden.
Welcher Zeitraum wird bei der postoperativen Piritramid-Gabe beobachtet?
Was macht man, wenn der Patient nur kurz im Aufwachraum liegt?
Hiermit ist gemeint, dass der Piritramid-Verbrauch für 1,5h im Aufwachraum beobachtet und dokumentiert werden soll.
Sollte der Patient länger im Aufwachraum sein, wird nur der Piritramid-Verbrauch in den ersten 1,5h gezählt.
Sollte der Patient deutlich kürzer im Aufwachraum sein und eine Weiterverfolgung des Piritramid-Verbrauchs nicht möglich sein, wird der Verbrauch bis zur Verlegung aus dem Aufwachraum gewertet.
Zählt bei der Frage nach der PONV-Prophylaxe auch die intraoperative Gabe, da es erst in Visite 2 abgefragt wird?
Die Frage nach erfolgter PONV-Prophylaxe ist im CRF in Visite 2 (PACU/ICU) zu finden. Sie bezieht sich aber auf PONV-Prophylaxen, die im Rahmen der Operation bzw. zu Beginn der Operation verabreicht wurden.
Die Abfrage erfolgt erst postoperativ im Rahmen der Aufwachraum-Visite, da sie im Zusammenhang mit der Frage nach einer aufgetretenen postoperativen Übelkeit (mit oder ohne Erbrechen) steht.
Fragen zu Visite 3: Postoperative Day 1
Was macht man, wenn die Visite 3 nicht am 1. postoperativen Tag bzw. gar nicht erfolgen kann?
Sollte es organisatorisch nicht möglich sein, die Visite 3 am ersten postoperativen Tag durchzuführen, bitten wir Sie im Sinne des „Intention to treat“ Prinzips, die Visite zum nächstmöglichen Zeitpunkt durchzuführen. Bei der Eingabe im OpenClinica tragen sie das Datum der Durchführung ein und setzen anschließend ein Fähnchen mit einer kurzen Begründung.
Falls die Visite 3 gar nicht erfolgen kann (z.B. bei einem Patienten der doch nur ambulant gelaufen und per Telefon nicht erreichbar ist), melden Sie uns bitte den Patienten, damit wir das Event für Sie in OpenClinica stoppen können. Hier muss dann nichts dokumentiert werden. Die Follow-Up Visite sollte aber trotzdem normal durchgeführt werden.
Wann benutze ich den 3D-CAM und wann den CAM-ICU?
Bei IMPACT soll primär der 3D-CAM zur Delirtestung angewandt werden.
Sollte sich der Patient unerwartet auf einer Intensivstation befinden und die Fragen des 3D-CAMs nicht beantworten können, bitten wir Sie den CAM-ICU durchzuführen.
Da diese Test nicht im CRF integriert sind, bitten wir Sie die Vorlagen (wurden per Mail versendet) auszudrucken und zum Patienten mitzunehmen.
Wie funktioniert die Punktevergabe bei der Uhr im MiniCog?
Nur für die komplett korrekt gezeichnete Uhr mit richtiger Uhrzeit gibt es 2 Punkte. Andernfalls sind 0 Punkte zu vergeben. Es gibt immer wieder Patienten, welche die Uhr größtenteils richtig zeichnen, aber eine Zahl vergessen oder die Zeiger falsch eintragen. Auch in solchen Fällen werden nur 0 Punkte vergeben.
Fragen zu Visite 4: Postoperative Day 30 (follow-up visit)
Wann genau soll die Follow-Up Visite stattfinden? Wie zählt man die Tage?
Das Datum der Visite 4 soll 30 Tage (+/- 3 Tage) nach der OP stattfinden. D.h., wird der Patient montags operiert, wäre Dienstag Tag 1, Mittwoch Tag 2, etc.
Wie genau zählt man die Tage für die Angabe des Hospital length of stay?
Der Hospital length of stay bezieht sich auf den primären stationären Krankenhausaufenthalt, der den initialen operativen Eingriff beinhaltet. Tag 1 ist der Tag der Operation. Der Entlasstag wird nicht mitgezählt. Wiederaufnahmen nach Entlassung aus dem Krankenhaus werden nicht mit einberechnet. Sollte der Patient doch ambulant behandelt worden sein (Ausschlusskriterium), und der Operationstag gleich dem Entlasstag sein, dann entspricht dies einem „Hospital length of stay“ von 1. Sollte der Patient 30 Tage nach dem Eingriff noch nicht entlassen worden sein, bitten wir Sie eine 31 hier einzutragen.
Wie genau zählt man die Tage für die Angabe des ICU length of stay?
Diese Angabe bezieht sich auf den primären stationären Krankenhausaufenthalt, der den initialen operativen Eingriff beinhaltet. Tag 1 ist immer der Aufnahmetag auf die Intensivstation. Der Entlasstag von der Intensivstation wird nicht mehr mitgezählt. Sollte der Aufnahmetag gleichzeitig der Entlasstag sein, dann entspricht dies einem „ICU length of stay“ von 1 (Beispiel: Patient wird morgens auf die Intensivstation aufgenommen und abends entlassen). Bitte zählen Sie bei dieser Frage alle Intensivstationsaufenthalte im Rahmen des primären stationären Aufenthaltes zusammen. Als ICU wird eine Intensivstation bezeichnet, auf welche die Patienten üblicherweise intubiert verlegt werden können. Eine sog. deutsche „Intermediate Care“ soll hier nicht dazu gezählt werden.
Wie geht man mit einem Patienten um, der „lost-to-follow-up“ ist? Welche Daten sind in diesem Fall in Visite 4 auszufüllen?
Ist ein Patient trotz aller Bemühungen „lost to follow up“, so soll im End of Trial Event das Kästchen „Lost to follow-up“ ausgewählt werden. In Visite 4 können die Felder bzgl. der Länge des Krankenhaus- und Intensivstationaufenthaltes mit Hilfe der vorliegenden Informationen aus dem Krankenhausinformationssystem dennoch ausgefüllt werden. Felder, die nicht beantwortet werden können, sollen mit einem Fähnchen gekennzeichnet werden. Es ist hilfreich, die Telefonnummer des Patienten schon in der Baselinevisite auf Richtigkeit zu überprüfen.
Fragen zu End of Trial
Wie füllt man das End of Trial bei einem Patienten aus, …
… dessen OP ungeplant ≤30min war?
Ist ein Eingriff ungeplanter Weise doch kürzer als 30min, soll der Patient im Sinne der „Intention to treat“ – Analyse wie alle anderen Patienten weiterverfolgt werden. Diese Patienten werden von uns später separat analysiert. In dem Reiter „End of Trial“ soll die Einschränkung unter Primary reason „other“ angegeben werden, z.B. mit den Worten „OP-Dauer <30min“.

… der ungeplant nur eine Analgosedierung bekommen hat?
Hat ein Patient ungeplanter Weise doch nur eine Analgosedierung bekommen, soll der Patient im Sinne der „Intention to treat“ – Analyse wie alle anderen Patienten weiterverfolgt werden. Diese Patienten werden von uns später separat analysiert. In dem Reiter „End of Trial“ soll die Einschränkung unter Primary reason „other“ angegeben werden, z.B. mit den Worten „nur Analgosedierung erhalten“.

… der ungeplant nur ambulant lief?
Wurde ein Patient ungeplanter Weise doch nur ambulant operiert, soll der Patient im Sinne der „Intention to treat“ – Analyse wie alle anderen Patienten weiterverfolgt werden. Diese Patienten werden von uns später separat analysiert. In dem Reiter „End of Trial“ soll die Einschränkung unter Primary reason „other“ angegeben werden, z.B. mit den Worten „ambulante OP“.

… der ungeplant nur eine Regionalanästhesie erhalten hat?
Hat ein Patient ungeplanter Weise doch nur eine Regionalanästhesie bekommen, soll der Patient im Sinne der „Intention to treat“ – Analyse wie alle anderen Patienten weiterverfolgt werden. Diese Patienten werden von uns später separat analysiert. In dem Reiter „End of Trial“ soll die Einschränkung unter Primary reason „other“ angegeben werden, z.B. mit den Worten „nur Regionalanästhesie“.
